Utforsker levende bioterapeutika for tilbakevendende Clostridioides difficile
US Pharm. 2024;49(12):19-23.
SAMMENDRAG: Ved behandling av tilbakevendende Clostridioides difficile-infeksjoner er det viktig å utforske alternativer til antibiotika på grunn av risikoen for ytterligere forstyrrelse av tarmmikrobiota. Disse alternativene inkluderer tradisjonell fekal mikrobiotatransplantasjon (FMT) og nyere typer FMT i form av levende bioterapeutiske produkter (LBP). Mens tradisjonell FMT er avhengig av ikke-standardiserte donoravføringsprøver, gir LBP en mer enhetlig og konsistent tilnærming til mikrobiotatransplantasjon. FDA har godkjent to LBP-er, Rebyota og Vowst, som alternativer av farmasøytisk kvalitet, med tilleggsprodukter under utvikling. Farmasøyter spiller en avgjørende rolle i å utdanne pasienter om opprinnelsen og den terapeutiske rollen til disse produktene.
Clostridioides difficile er en sporedannende bakterie som er primært ansvarlig for å forårsake smittsom diaré, spesielt hos pasienter som nylig ble behandlet med antibiotika som fluorokinoloner, visse cefalosporiner og klindamycin. Administreringen av disse og andre antibiotika forstyrrer tarmmikrobiotaen, noe som muliggjør C diff å kolonisere og spre seg i tarmene. C diff Infeksjon (CDI) er den vanligste helserelaterte infeksjonen, som bidrar til lengre sykehusopphold og høyere dødelighet. 1
Historisk sett var metronidazol og vankomycin, begge relativt bredspektrede antibiotika, standardbehandlingene for CDI. Disse stoffene er knyttet til skuffende høye forekomster av tilbakefall av CDI, men sannsynligvis fordi de forstyrrer tarmmikrobiotaen under behandlingen. 2 Fidaxomicin, et smalere spektrum antibiotikum, har betydelig lavere tilbakefallsfrekvens og en forbedret sikkerhetsprofil sammenlignet med vankomycin. 1.2 Bruken av dette nyere alternativet har imidlertid vært begrenset på grunn av den høye kostnaden. 1
Tilbakevendende episoder av CDI
CDI er notorisk utfordrende å behandle, med tilbakevendende infeksjoner som utgjør betydelige hindringer som krever innovative tilnærminger. Som et stort folkehelseproblem, tilbakevendende C diff Infeksjoner (rCDI) nødvendiggjør ofte fekal mikrobiotatransplantasjon (FMT) etter to eller flere tilbakevendende episoder. FMT, som innebærer å gjenopprette tarmmikrobiomet ved å bruke enten donoravføringsprøver eller dyrkede cellebanker, har vist lovende resultater på tvers av ulike applikasjoner.
Etter en innledende episode med CDI står pasienter overfor opptil 25 % risiko for rCDI, og de som opplever flere residiv har opptil 75 % sjanse for påfølgende tilbakefall. 2 Infectious Diseases Society of America (IDSA) og Society for Healthcare Epidemiology of America (SHEA) definerer rCDI som en gjentakelse innen 8 uker etter å ha løst en tidligere episode, selv etter vellykket behandling. 1 Deres retningslinjer anbefaler å vurdere FMT som en alternativ behandling for pasienter med rCDI etter fullført antibiotikabehandling. 3 IDSA foreslår at FMT kun bør tilbys etter passende antibiotikabehandlinger for minst to tilbakefall (dvs. tre CDI-episoder). 3
Hva er FMT?
FMT er en prosedyre som introduserer sunn donoravføring i en pasients tarm for å gjenopprette hans eller hennes tarmmikrobiota til en sunn tilstand. 4 Det innebærer å overføre minimalt bearbeidede mikroorganismer fra en giver til en mottaker, med fekalt materiale som er spesifikt brukt i denne prosessen. Avføringsprøver fortynnes vanligvis med sterile væsker og administreres kort tid etter tilberedning. 5 De leveres vanligvis rektalt via et klyster under koloskopi eller gjennom nasogastriske eller nasoduodenale rør. 5.6 Oral FMT via kapsler med utvidet frigivelse har vist en effekt som er sammenlignbar med andre leveringsmetoder og er tilgjengelig fra avføringsbanker og forskningssentre. 6 Dette alternativet er egnet for pasienter som ikke trenger koloskopi og tåler oral administrering, selv om yngre barn generelt ikke er kandidater på grunn av størrelsen og antallet kapsler. 6
Den mikrobielle sammensetningen av hver FMT-intervensjon kan variere betydelig på grunn av forskjeller i donoravføring og forberedelsesmetoder som brukes av ulike fasiliteter. 5 Mens potensielle FMT-givere må gjennomgå grundig screening og seleksjon, er det begrensede data om hvordan donorkarakteristikker påvirker FMT-utfall. 5.6 Gjeldende anbefalinger for donorvalg er basert på ekspertuttalelser i stedet for solid bevis. 6 Denne mangelen på standardisering og variasjon i screeningspraksis byr på utfordringer for både regulatorer og klinikere, noe som gjør FMT-forberedelse mer til en kunst enn en vitenskap. 6
FMT er svært effektivt for å forhindre tilbakefall av CDI fordi det direkte repopulerer tarmmikrobiotaen i stedet for bare å undertrykke C diff vekst, og gjenoppretter derved mikrobiota-mangfold og funksjon. 7 FMT-terapi har oppnådd ~92 % effekt ved behandling av rCDI og har vist seg å være overlegen fidaxomicin og standarddose vancomycin monoterapier når de brukes etter en kort kur med vancomycin. 1.8 Studier indikerer at FMT signifikant endrer mottakerens tarmmikrobiom, spesielt mengden av bakterieoideter, for å ligne den til den friske giveren. 5
Levende bioterapeutiske produkter
Selv om tradisjonelle FMT-metoder anses som relativt sikre, vedvarer det bekymringer angående anskaffelse av donorfekalt materiale og overføring av det til pasienter, spesielt de som er immunkompromittert. Til tross for en streng donorutvelgelsesprosess, har FDA utstedt sikkerhetsvarsler om FMT på grunn av risikoen for overføring av patogene bakteriestammer. 2,5,9 I 2019 utstedte FDA et sikkerhetsvarsel etter at to immunkompromitterte voksne utviklet invasiv Escherichia coli infeksjoner etter FMT, og norovirus gastroenteritt er rapportert hos FMT-mottakere til tross for asymptomatiske donorer. 5.9 Aspirasjon er en risiko ved levering av FMT gjennom et endoskop, med ett tilfelle som fører til døden til en 80 år gammel pasient med rCDI. 6 I tillegg understreket COVID-19-pandemien relevansen av risikoen for overføring av patogener fra donor til mottaker, og påførte restriksjoner og komplisert rekruttering av avføringsdonorer. 2,11,12 Gitt disse bekymringene med FMT, oppsto behovet for å formulere enhetlige FMT-produkter med forbedrede sikkerhetsprofiler samtidig som inkonsekvensene ble minimalisert.
I henhold til FDA-definisjoner er levende bioterapeutiske produkter (LBP) ikke-vaksine biologiske midler som inneholder levende organismer, for eksempel bakterier, som brukes til å forebygge, behandle eller kurere sykdommer eller tilstander hos mennesker. 2.5 LBPer gis som en målrettet form for FMT-terapi etter fullføring av standard antibiotikabehandling for rCDI. LBP-er skiller seg fra tradisjonelle FMT, ettersom de er klassifisert av FDA som biologiske legemidler, noe som markerer et reguleringsskifte for disse terapiene, som vist i TABELL 1 . 2.5 Siden FMT involverer marginalt behandlet donoravføring, klassifiserer FDA tradisjonell FMT som et undersøkelsesmiddel. 2 I motsetning til dette må LBP-er produseres i henhold til retningslinjer for god produksjonspraksis og må studeres i kliniske studier for å få FDA-godkjenning, i likhet med farmasøytiske legemidler. 2,5,11

Nåværende LBP-er kan kategoriseres etter deres mikrobielle kilder, med en type som er avledet fra menneskelige donorer. Friske avføringsgivere deltar i konsekvent screening for 29 forskjellige patogener for å redusere risikoen for smitte, som pålagt av FDA. 5.12 Disse produktene gir større standardisering i produksjonen, og inkluderer ofte ekstra filtrering og behandling for å avgrense bakterieutvalget i hel avføringsdonasjoner. I likhet med tradisjonell FMT, kan imidlertid mengden og mangfoldet av mikrobielle prøver variere mellom partier av donoravledede LBPer. FDA erkjenner denne variasjonen og forventer at donoravføringsprøver generelt gjenspeiler den mikrobielle sammensetningen som er typisk for den bredere befolkningen.
I en andre metode er et konsortium av flere mikrober konstruert som et medikament, ved å bruke cellelinjeisolasjon for å levere et spesifikt utvalg av gunstige bakteriekulturer. 13 Standardiseringen av LBPer representerer et stort sprang fremover i FMT, og skifter fra kompleksiteten til flere nye undersøkelsesapplikasjoner til potensialet for masseproduksjon og bredere tilgjengelighet.
Kommersielt tilgjengelige LBPer
LBPer anbefales for å forhindre tilbakefall hos pasienter som har opplevd to eller flere episoder av CDI etter nedtrappet behandling med vancomycin eller fidaxomicin. 5.9 FDA har godkjent to LBP-produkter for forebygging av rCDI: Rebyota (fecal microbiota, live-jslm), godkjent i 2022, og Vowst (fecal microbiota spores, live-brpk), godkjent i 2023. Vowst er beregnet til å koste $17.500, mens Rebyota koster omtrent $9 100, som presentert i TABELL 2 . 1 Denne utgiften kan imidlertid være berettiget sammenlignet med de høye kostnadene ved sykehusinnleggelse for rCDI, som varierer fra $67.837 til $82.268. 10 Rebyota er et kryokonservert og filtrert hel avføringsprodukt som inneholder et mangfoldig utvalg av fekale mikrober, inkludert Bacteroides , som leveres i en rektal løsning. 2,5,9,12 Avføring fra kvalifiserte givere blir rutinemessig screenet for multiresistente stammer, og hver batch av Rebyota testes for å sikre standardisering med ønsket levende telling av spesifikke bakteriearter. 2.5 Ingen tarmforberedelse er nødvendig før administrering av Rebyota, og enkeltdoseprosedyren bør skje 24 til 72 timer etter siste dose CDI-antibiotika. 9 Rebyota gis av en helsepersonell som et klyster ved hjelp av gravitasjonsflyt, med pasienten plassert på venstre side eller i en kne-bryststilling. 5.12 Pasienten bør forbli i denne posisjonen i opptil 15 minutter for å redusere sjansen for kramper, og det er ingen begrensninger på bruk av toalett etterpå.
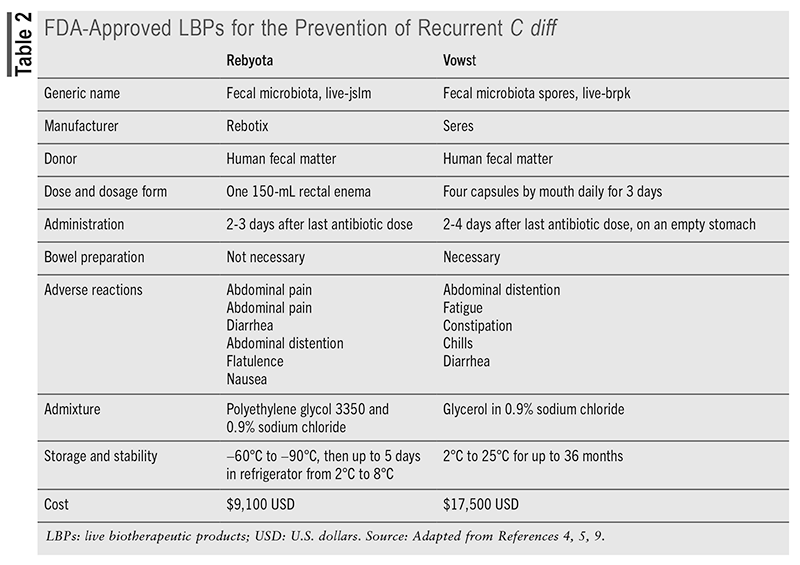
Av de farmasøytiske LBP-ene ligner Rebyota mest på tradisjonelle FMT-terapier. Rebyota garanterer spesifikk håndtering og krever lagring i frossen tilstand før den overføres til kjøleskap innen 5 dager etter bruk. 5.10 Anskaffelsesalternativer inkluderer å bestille gjennom en spesialforhandler eller spesialapotek og få det administrert av en helsepersonell på ethvert omsorgssted. For pasienter som står overfor plasseringsbegrensninger, fysiske begrensninger eller administrative utfordringer, styrer Rebyota @ Home-tjenesten prosessen, med hjemmesykepleiere som koordinerer administrasjonen. 14
Klinisk støtte for Rebyota-bruk kommer hovedsakelig fra fire publiserte kliniske studier samlet kalt PUNCH-studiene. Rebyota viste konsekvent overlegen effektivitet sammenlignet med behandlinger som kun inneholder antibiotika for å forhindre rCDI, med over 90 % av vellykkede pasienter som forblir tilbakefallsfrie etter 6 måneder. 5.9 Det tolereres generelt godt, med milde gastrointestinale bivirkninger som magesmerter (8,9 %), diaré (7,2 %), abdominal oppblåsthet (3,9 %) og flatulens (3,3 %) som de hyppigst rapporterte. 9 Rebyota viste forbedringer i helserelatert livskvalitet, tatt i betraktning stoffets pris og dets rolle i å redusere sykehusinnleggelser. 12
Vowst (fecal microbiota spores, live-brpk) er FDA-godkjent for å forhindre rCDI og er den første orale LBP, gitt i kapsler avledet fra fekale prøver fra friske givere. 9.12 Vowst består av en blanding av rensede sporer fra rundt 50 arter innenfor Firmicutes phylum, som virker ved å gjenopprette tarmmikrobiota og hemme spiring, replikasjon og toksinproduksjon av C diff . 1.12 Donoravføring gjennomgår et etanolbasert inaktiveringstrinn for å eliminere ikke-spore organismer, etterfulgt av filtrering for å isolere Firmicutes sporer og fjern eventuelle rester. 9 Sporekonsentrasjonen måles deretter for å sikre konsistens, noe som resulterer i en standardisert blanding av Firmicutes sporer som tåler gastrointestinale syrer når de administreres oralt. 2.9
Pasienter bør ha fullført anti- C diff antibiotika og vent 2 til 4 dager etter siste antibiotikadose før du tar den første dosen av Vowst. 1.12 I tillegg bør magnesiumsitrat tas kvelden før Vowst begynner som en tarmrens og for å nøytralisere eventuelle resterende antibiotika i mage-tarmkanalen. 1,9,12 Fire kapsler bør tas daglig i 3 påfølgende dager (totalt 12 kapsler) på tom mage før dagens første måltid, med kun minimalt med vann tillatt i denne perioden. 9.12 De reseptbelagte kapslene bestilles gjennom en Vowst-utpekt spesialforhandler eller spesialapotek.
Fire kliniske studier viste effekten av Vowst, med behandlingsrelaterte bivirkninger primært milde til moderate og hovedsakelig gastrointestinale. I en studie var tilbakefall av CDI innen 8 uker 12 % i Vowst-gruppen, mens det var 40 % i placebogruppen. 9.12 En annen studie fant at administrasjon av Vowst resulterte i reparasjon av mikrobiom og opprettholdt en vedvarende respons i opptil 24 uker etter behandling. 12 Hovedfordelen ble funnet å være dens evne til å gjenopprette koloniseringsresistens i tarmen og øke metabolsk konkurranse mot C diff . 1 Sikkerhetsdata indikerte at de hyppigste bivirkningene var abdominal oppblåsthet (31 %), forstoppelse (14,4 %) og diaré (10,0 %), med en overfølsomhetsreaksjon som den eneste alvorlige bivirkningen. 5.9 Som med andre LBP-er og FMT-prosedyrer, er Vowst også underlagt advarsler om potensiell risiko for overføring av smittsomme organismer.
Undersøkende LBPer
RBX7455, også utviklet av Rebiotix, er en standardisert, lyofilisert LBP som for tiden testes for oral bruk hos pasienter med rCDI. 5.15 Dette produktet er produsert ved hjelp av dobbelt innkapslede V-caps og er avledet fra de samme mikrobene som brukes i Rebyota klyster. 15 I tillegg til bruken for rCDI, blir RBX7455 evaluert for sine immunmodulerende effekter ved tilstander som brystkreft, hepatisk encefalopati og Crohns sykdom. 5 Rebiotix har til hensikt å få godkjent RBX7455 som et oralt alternativ til Rebyota.
VE303 er en undersøkende LBP som består av en unik blanding av Clostridial arter og administreres oralt i kapselform. 5.9 I motsetning til andre LBPer som bruker fekalt donormateriale, er VE303 produsert fra åtte forskjellige Clostridial stammer dyrket fra kolonicellebanker, noe som kan forbedre konsistens og standardisering. 5.11 Det krever ingen tarmforberedelse og tas som 10 kapsler daglig i 14 dager. 11 VE303 mottok Orphan Drug Designation i 2017 og Fast Track Designation i 2023 fra FDA for å forhindre rCDI. 5 Både fase I- og fase II-studier har møtt primære endepunkter, noe som viser lovende for fremtidige store studier. 1 I tillegg er VE303 under utredning for behandling av hepatisk encefalopati. 5
Andre undersøkelses-LBPer inkluderer CP101 av Finch Therapeutics Group og MET-2 av MaaT Pharma. 2.15 CP101 er en oral, enkeltdose, frysetørket kapsel som inneholder en mangfoldig mikrobiota som har mottatt FDA banebrytende terapi og fast-track betegnelser. 1.5 Selv om de spesifikke bakteriekomponentene og kolonidannende enhetene per dose ikke er avslørt, har Finch Therapeutics patenter for behandlinger rettet mot C diff med en blanding av aktinobakterier, proteobakterier, firmicutes og bacteroidetes. 15 MET-2 består av en proprietær blanding av 40 arter, renset og lyofilisert til kapsler for oral bruk. Opprinnelig isolert fra frisk donoravføring, produseres MET-2 uavhengig av giveren for å redusere risikoen forbundet med helseforandringer hos donorer. 15,16
Farmasøytens rolle
I flere tiår var det ingen FMT-alternativer av farmasøytisk kvalitet tilgjengelig før FDA godkjente Rebyota. Fekalt materiale for FMT-er er ofte hentet fra avføringsbanker, for eksempel den ideelle organisasjonen OpenBiome. Disse bankene samler inn, screener og lagrer avføring fra friske givere, som leger deretter bruker til pasientbehandling. 17 Skiftet fra tradisjonelle FMT til farmasøytisk-grade LBPer gir farmasøyter større muligheter til å engasjere seg i rådgivning og pasientbehandling. Farmasøyter kan delta i flere stadier av LBP-levering, inkludert sourcing, tilrettelegging av helseforsikringsdekning og pasientrådgivning. I tillegg, siden LBP inneholder aktive bakterier, vekker bruken bekymring sammenlignet med tradisjonelle legemidler, noe som understreker behovet for ytterligere forskning for å avgrense tilleggsterapier og forbedre resultatene gjennom legemiddelovervåking. 1 I det hele tatt krever effektiv behandling av rCDI samarbeid mellom infeksjonsleger, farmasøyter og andre spesialister for å sikre helhetlig og koordinert pasientbehandling. 18
REFERANSER
1. Jain N, Umar TP, Fahner AF, Gibietis V. Fremskrittsbehandling for tilbakevendende Clostridioides difficile infeksjoner: en oversikt over vowsts FDA-godkjenning og implikasjoner. Tarmmikrober. 2023;15(1):2232137.
2. Lavoie T, Appaneal HJ, LaPlante KL. Fremskritt i nye levende bioterapeutiske produkter for Clostridioides difficile infeksjonsforebygging. Clin Infect Dis. 2023;77(Suppl 6):s447-s454.
3. Mada PK, Alam MU. Clostridioides difficile infeksjon . In: StatPearls. StatPearls Publishing; 2024. www.ncbi.nlm.nih.gov/books/NBK431054/.
4. Gonzales-Luna AJ, Carlson TJ, Garey KW. Tarmmikrobiota endringer assosiert med Clostridioides difficile infeksjon og dens ulike behandlingsstrategier. Tarmmikrober. 2023;15(1):2223345.
5. Stallhofer J, Steube A, Katzer K, Stallmach A. Mikrobiotabaserte terapier som ny standardbehandling for tilbakevendende behandlinger Clostridioides difficile infeksjon. Visc Med. 2024;40(2):82-91,6. Aby ES, Vaughn BP, Enns EA, Rajasingham R. Kostnadseffektivitet av fekal mikrobiotatransplantasjon for første tilbakevendende Clostridioides difficile infeksjon. Clin Infect Dis. 2022;75(9):1602-1609.
7. Johnson S, Lavergne V, Skinner AM, et al. Retningslinje for klinisk praksis av Infectious Diseases Society of America (IDSA) og Society for Healthcare Epidemiology of America (SHEA): 2021 fokuserte oppdateringsretningslinjer for håndtering av Clostridioides difficile infeksjon hos voksne. Clin Infect Dis. 2021;73(5):e1029-e1044.
8. Wang Y, Hunt A, Danziger L, Drwiega EN. En sammenligning av tilgjengelige og undersøkende fekale mikrobiota-transplantasjonsprodukter for tilbakevendende Clostridioides difficile infeksjon. Antibiotika (Basel). 2024;13(5):436,9. Grigoryan Z, Shen MJ, Twardus SW, et al. Fekal mikrobiotatransplantasjon: bruk, spørsmål og etikk. Med Microecol. 2020;6:100027.
10. Davidovics Z. Fekal transplantasjon. I Wyllie R, Hyams JR, Kay M, red.: Pediatrisk gastrointestinal og leversykdom. 6. utg. Elsevier; 2021:1039-1042.
11. Barron M. Fecal microbiota transplants (FMT): fortid, nåtid og fremtid. ASM.org. 2024. https://asm.org/articles/2024/february/fecal-microbiota-transplants-past-present-future. Accessed August 8, 2024.
12. Gonzales-Luna AJ, Carlson TJ, Garey KW. Gjennomgangsartikkel: sikkerhet for levende bioterapeutiske produkter som brukes til forebygging av Clostridioides difficile infeksjon tilbakefall. Clin Infect Dis. 2023;77(Suppl 6):S487-S496. 13. Jolaiya T, Smith S. Utviklende teknologier i gastrointestinal mikrobiom-æra og deres potensielle kliniske anvendelser. I: Pellicano R, Fagoonee S, Ajayi A, red. 3Ts i gastrointestinal mikrobiome-æra: teknologi, translasjonsforskning og transplantasjon. MDPI; 2021:4.
14. DuPont HL, DuPont AW, Tillotson GS. Mikrobiota restaureringsterapier for tilbakevendende Clostridioides difficile infeksjon nå en viktig ny milepæl. Terap Adv Gastroenterol. 2024;17:9.
15. McChalicher CW, Auniņš JG. Druging av mikrobiomet og bakteriell levende bioterapeutisk konsortiumproduksjon. Curr Opin BIotechnol. 2022;78:102801.
16. Høydepunkter for Rebyota-administrasjon: Rebyota-administrasjon – én dose. Ett komplett mikrobiombasert bioterapeutisk middel. 5. juni 2024. www.rebyotahcp.com/why-rebyota/#rebyota-administration-highlights. Accessed October 3, 2024.17. Kao D, Wong K, Franz R, et al. The effect of a microbial ecosystem therapeutic (MET-2) ved tilbakevendende Clostridioides difficile infeksjon: en fase 1, åpen, enkeltgruppeforsøk. Lancet Gastroenterol Hepatol. 2021;6(4):282-291:8.
18. Haber SL, Raney CRK, Larson TL, Lau JP. Fekal mikrobiotatransplantasjon for tilbakevendende Clostridioides difficile infeksjon. Am J Health Syst Pharm. 2019;76(13):935-942.
Innholdet i denne artikkelen er kun til informasjonsformål. Innholdet er ikke ment å være en erstatning for profesjonell rådgivning. Å stole på all informasjon gitt i denne artikkelen er utelukkende på egen risiko.











